- 爱妻自媒体-微信公众平台文章推荐

[转载出处:www.ii77.com]
引用本文:虞淦军,万涛,王闻雅等.国际细胞和基因治疗成品监管对照及对我国的启迪[J].中国食品药品监管.2019.8(187):4-19.
[原文来自:www.ii77.com]

生物治疗是现代生物手艺、基因工程手艺、分子生物学、医学遗传学、临床医学等多学科交叉、融合而形成的,用于治疗人类重浩劫治性疾病的新型治疗手段,包罗细胞治疗、基因治疗等。跟着科学手艺和生物手艺的络续成长,人们起头使用分子更大、构造更复杂的生物手艺用于疾病的治疗,现在细胞也已经成为了一种主要的治疗“药物”[1]。细胞和基因治疗在恶性肿瘤、传染性疾病、自身免疫性疾病等重浩劫治性疾病的治疗中日益显露出精巧的前景,成为人类干涉疾病的又一主要手段。近十年来,国际上细胞和基因治疗应用研究取得了一系列冲破性进展,相关财富也旭日东升。稀奇是2017 年美国食品药品监视治理局(Food and DrugAdministration,FDA) 核准了2 项CAR-T(Chimeric antigen receptor-T,CAR-T)细胞治疗产物,国际上接踵核准多项免疫细胞治疗产物,引起了国表里细胞和基因治疗范畴的研发烧潮,并已逐渐形成全球新兴财富成长集群[2-5]。
回首我国细胞和基因治疗的成长汗青,在细胞治疗手艺属性和产物属性的络续争议中,其根蒂研究和临床转化与应用储蓄了必然的经验,已有多项相关规范性文件和行业准则发布实施,但在该范畴尚未形成完美的监管政策系统。作为一个新兴的财富,从根蒂研究到产物研发、审批上市、市场准入莅临床应用的全链条、全生命周期治理着眼,细胞和基因治疗成长过程中还存在诸多挑战。为此,在深刻懂得细胞和基因治疗产物特点的根蒂上,周全认识财富成长近况和今朝以及将来或者碰见的问题,理清监管思路,出台具有前瞻性的细胞和基因治疗监管政策,制订科学有效的实施路径,对鞭策财富成长,对解决公家和患者对新兴治疗产物的临床治疗需求将有重大的意义。
本文综合剖析了我国细胞和基因治疗行业成长近况,总结了该范畴面临的首要问题和挑战,横向梳理了国际上其他国度或区域以及我国细胞和基因治疗监管政策系统和特点,为进一步厘清相符我国国情的监管路径,索求竖立和慢慢完美相符国情、具有中国特色的科学的监管政策系统提出建议。


近年来,跟着分子生物学手艺、基因工程手艺和基因编纂手艺的络续成长,无论是根蒂研究照样临床研究,细胞和基因治疗范畴都取得了冲破性进展,其成长速度可谓日新月异。
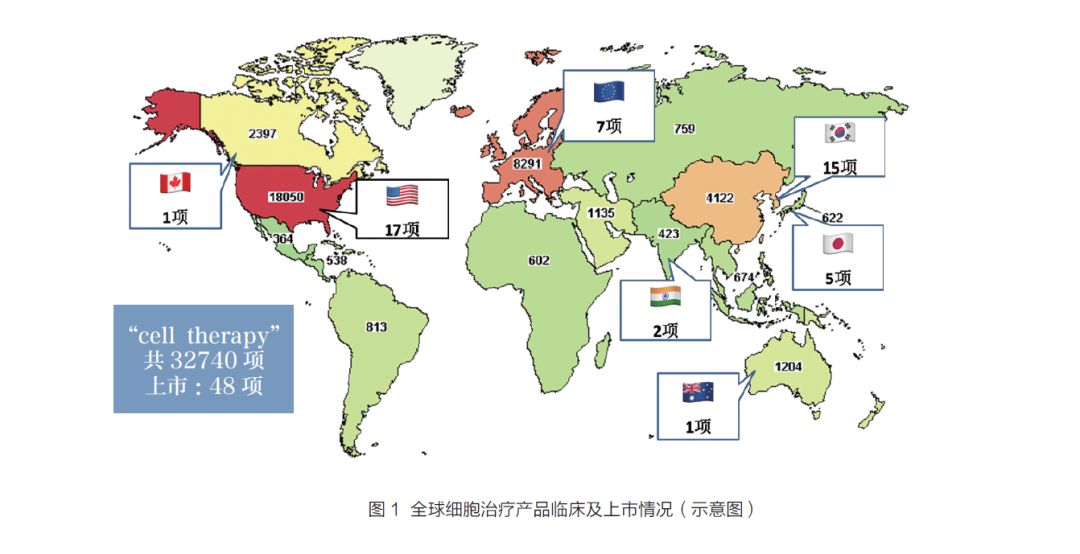
细胞治疗是指应用人的自体、同种异体或异种(非人体)的细胞,经体外把持后回输(或植入)人体的治疗方式。这种体外把持包罗细胞在体外的传代、扩增、筛选以及赐与药物或其他能改变细胞生物学行为的处理。经由体外把持后的细胞可用于疾病的治疗[6]。今朝最常见的是免疫细胞治疗和干细胞治疗。免疫细胞治疗首要包罗树突状细胞(dendritic cell,DC)、天然杀伤细胞(natural killer cell,NK cell)、各类细胞因子等策略活化诱导的T 细胞(如CIK 等)以及基因润饰的T 细胞(CAR-T 细胞和TCR-T 细胞)等,干细胞治疗有胚胎干细胞、间充质干细胞、诱导性多能干细胞(induced pluripotentstem cells,iPS cells)。截止2019 年4 月,美国clinicaltrials.gov 网站挂号的全球开展的细胞治疗产物临床试验约32 740 项,共48 个细胞治疗产物在美国、韩国、瑞士等国度上市。全球核准上市的免疫细胞产物有7 项,干细胞产物17项(图1)。在中国开展的细胞治疗产物临床研究有4122 项,约占全球的12%,尚未有产物在中国核准上市。
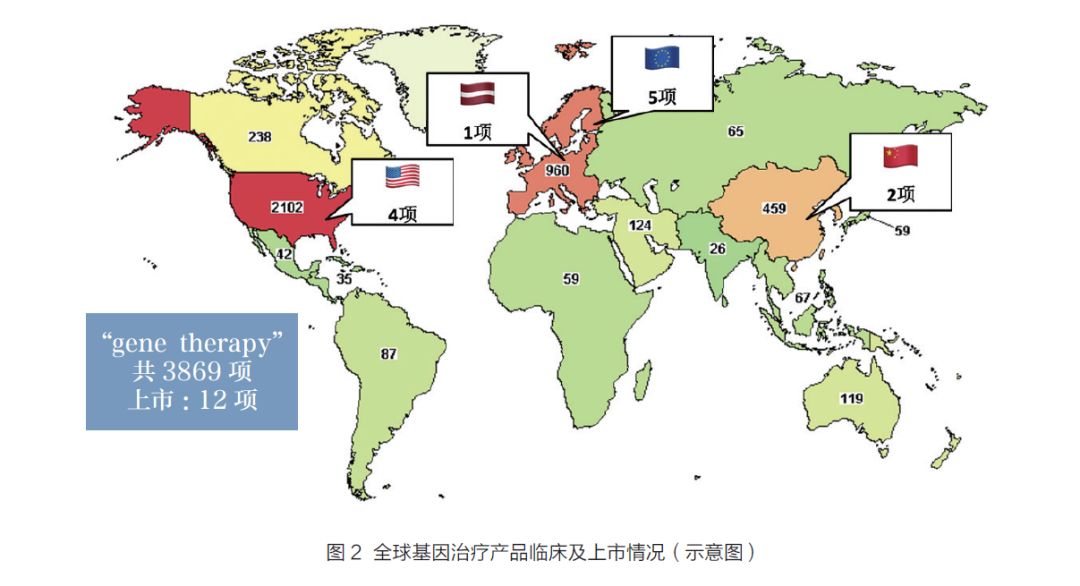
基因治疗是指改变细胞遗传物质为根蒂的医学治疗。基因治疗的手艺和体式日趋多样性。按基因导入的形式,分为体外基因导入(ex vivo)及体内基因导入(in vivo)两种形式。前者是在体外将基因导入细胞,然后将该细胞注入人体。其成品形式是外源基因转化的细胞,适合在具有专门手艺人才和前提的医疗单元单子进行。后者则是将基因经由适当的导入系统直接导入人体,包罗病毒载体的与非病毒载体的方式。其成品形式是基因工程手艺革新的病毒或许是重组DNA、RNA 等遗传物质及其复(混)合物[7]。广义上,只如果导入外源基因(DNA 或RNA)并施展响应功能的治疗手段都属于基因治疗。在基因治疗范畴,以北美、欧洲和东亚为主的约40 个国度正在开展对恶性肿瘤、单基因遗传病、传染性疾病和心血管疾病等的临床研究。截止2019 年4月,美国clinicaltrials.gov 网站挂号的临床试验3869 项,共12 项产物在中国、欧盟和美国上市。在中国开展的有459 项,约占全球的11%,2 个产物在中国核准上市(图2)。

相对于传统药物,细胞和基因治疗成品具有研发手艺含量高、手艺更新迭代快、产物有效期短、制备把持环节多、质量掌握难度高且要求严厉、个性化水平高、对临床大夫的协同要求高档特点,这对企业、医疗机构以及监管部门都提出了更高的要乞降新的挑战。
因为手艺新、更新快,业界对细胞和基因治疗的认识也在络续储蓄。列国和区域对于细胞和基因治疗产物的监管政策系统正在络续改善和完美,细胞和基因治疗行业也在慢慢前行、络续规范[8]。因为各个国度和区域文化、经济、地区、法系等国情和民情各不沟通,分歧国度和区域的卫生治理和药品监管系统的架构和本能有所分歧,但从审批上市和临床应用角度看,总体分为两类监管模式路径:一是由药品监视治理部门负责监管,按照风险品级分类治理,典型代表如美国、欧盟、德国、加拿大、新加坡、韩国等;二是由医疗卫生治理部门审核核准在医疗机构临床应用,而上市畅通产物则按照药品治理,典型代表是..。本文重点选择代表性的美国、欧盟和..的监管系统进行简要介绍[9-14]。
美国
1
监管组织架构

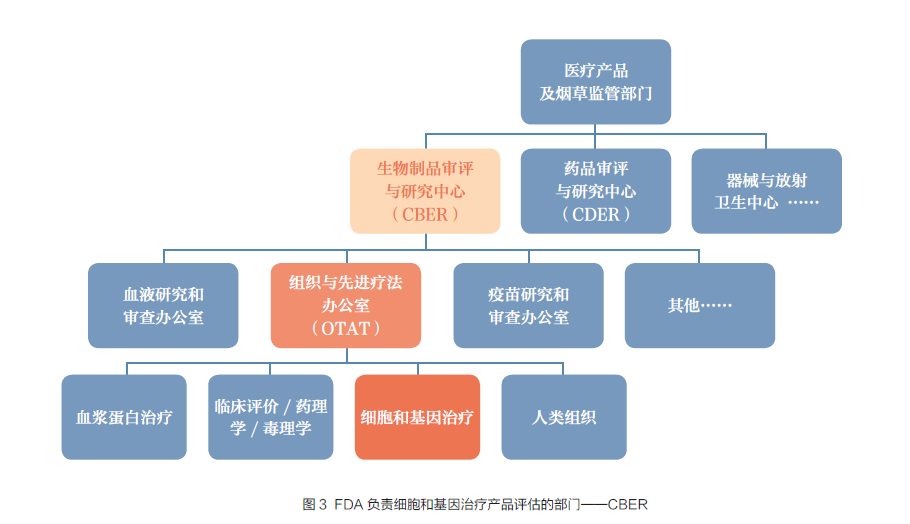
美国FDA 生物成品评价研究中心(Centerfor Biologics Evaluation and Research,CBER)负责生物成品以及血液、疫苗、细胞治疗、基因治疗和组织等相关产物。2016 年FDA 将本来的细胞、组织和基因治疗办公室改建为组织和进步疗法办公室(Office of Tissue and AdvancedTherapies,OTAT),负责细胞、基因和组织疗法等产物(图3)。
2
司法律例系统

(1) 总体框架
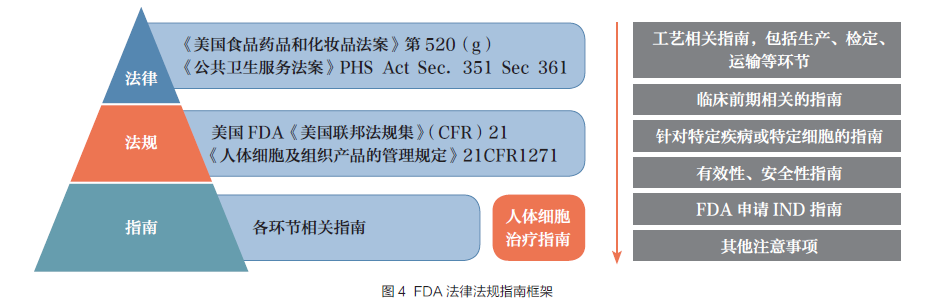
美国对于细胞和基因治疗的监管系统已经形成了由司法、律例、治理轨制与指南三层构成的相对完美的律例监管框架(图4)。在司法层面,《美国食品药品和化妆品法案》(FD&C Act)及《民众卫生办事法案》(Public Health Service Act,PHS Act)是细胞治疗产物治理的首要司法依据。《美国联邦律例集》(CFR)第21 部门是食品药品相关律例,个中2005 年收录的1271 号(21CFR1271),即《人体细胞和组织产物的治理划定》[8],是细胞治疗产物审批首要依据的律例,这个中最主要的内容之一是将人体细胞组织分为PHS 351 产物与PHS 361 产物两大类进行治理。对于基因治疗,美国并没有专门制订一整套完整的司法律例系统,而是将基因治疗纳入药品治理律例系统。1997年美国接踵对《民众卫生办事法案》和《美国食品药品和化妆品法案》进行修订,正式将基因治疗纳入药品治理律例框架中,并采用司法和咨询机构或..连系的治理模式。此外,FDA 还与其他细胞和基因治疗范畴治理部门、企业、研究机构互相沟通,形成了一系列关于生物产物制备、质控和临床试验的指南规范,接踵公布了30 余部相关律例和手艺指南(图5)。

基于风险治理原则,《民众卫生办事法案》将人体细胞和组织分为低风险产物(PHS ACT 351 章节)和高风险产物(PHS ACT 361 章节)两大类进行治理。低风险的产物不采用药品的监管模式,只需要在FDA 对其细胞产物机构和产物进行挂号,不需要申请上市前评估,按期接管FDA 搜检。高风险细胞治疗以及基因治疗产物被视为生物药类产物,除需进行机构和产物挂号外,还需遵循药品治理要求,向FDA 提交新药申请(investigation newdrug,IND) 和生物成品许可申请(biologicallicense application,BLA)(图6)。

按照风险分级原则,细胞/ 组织产物是否需要按照药品治理的要害在于是否相符PHS Act361 章节界定的情形,只要存在最小把持身分的产物,都严厉按照药品治理(表1)。是以,一些没有经由体外把持的组织被加入不需要按照药品生物成品治理,而细胞,即使仅仅是经由培育(如软骨细胞),也会被认为不属于“简洁”的把持而需要按照FDA 药品治理模式进行治理。
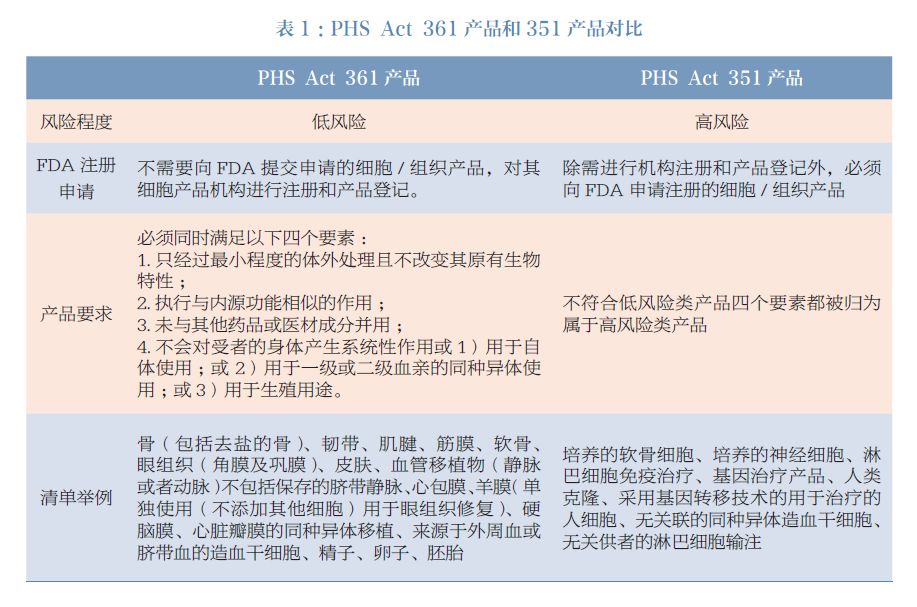
2018 年 FDA 发布了2 个指南, 个中《人体细胞、组织和细胞组织产物的监管考虑:最小把持和同源性使用》(Regulatory Considerationsfor Human Cells,Tissues,and Cellular andTissue-Based Products: Minimal Manipulation andHomologous Use)更清楚地界定了律例文件中“最小把持”和“同源性使用”的寄义,向好处相关方注释监管要求。在指南中清楚说明了以下适用于PHS Act 361,即不需要按照药品治理的特例景遇:
①仅用于非临床或教育目的。
②在统一个外科手术过程中将某小我体细胞和组织产物移出和植入回该个别。
③作为承运人,在平日的买卖过程中接管、领受、承运或交付人体细胞和组织产物。
④不涉及苏醒、筛选、检测、处理、定名、包装或分发人体细胞和组织产物,而是接管或保留人体细胞和组织产物并仅用于机构内的植入、移植、输注或转运使用。
⑤仅苏醒生殖细胞或组织,并立刻将其转移到细胞或组织救助者的伴侣体内。
⑥若是某个别与某个已经..的企业、组织或机构之间存在合同、和谈书或其他有关放置的约束,而且仅从事细胞或组织苏醒、将苏醒的细胞或组织交还给该..企业、组织或机构,该个别无需零丁对其经手的人体细胞和组织产物进行..和列表记录。

(2)IND 与宽免
原则上不适用PHS Act 361 界定前提的产物拟开展人体应用前都需要向FDA 提交新药临床试验申请。需要指出的是,FDA 界定了三种类其余IND。
①研究者IND :大夫提议的研究,在其直接指导下使用或分派研究药物。大夫能够提交研究者IND 以建议研究未经核准的药物,或用于新适应证或在新患者群体使用已核准产物。
②紧要使用IND :FDA 许可在紧要情形下授权使用临床试验药物,用于不相符现有研究方案尺度的患者,或许在不存在已核准研究方案的情形下使用。
③治疗IND :试验药物的..申请,这些试验药物在临床测试中对于严重或立刻危及生命的病症有受益的或者,而且研究方案经由了FDA 审查。
《美国联邦律例集》21CFR 中解说了宽免IND的情形。申办方可向FDA 提出恳求宽免IND。宽免恳求可在IND 中提交,也可在IND 的信息点窜中提交。在紧要情形下,可经由德律或其他快速通信手段提出恳求。宽免恳求必需至少包含以下一项:
①注释为何申办方不需要或达不到要求;
②或解说知足目的的备选申请或动作方案;
③或证实宽免的其他资料。
若是宽免IND 不会对介入研究的受试者组成重大且错误理的风险,而且相符下列前提之一时,FDA 能够赐与宽免:
①在评估申请时不要求申办方严厉遵守要求,或许无法达到合规要求;
②申办方提议的替代方案知足要求;
③或申请人的申请亦能够证实宽免是合理的。

(3)美国细胞和基因治疗监管政策新动态
2017 年,FDA 正式对再生医学发布了周全的政策指南《再生医学产物监管框架》(Comprehensive Policy Framework forRegenerative Medicine), 涵盖了加速产物斥地的多种策略, 个中包罗再生医学进步疗法认定(Regenerative Medicine AdvancedTherapies,RMATs)。2019 年2 月,FDA发布《针对严重疾病的再生医学疗法的快速审评规划》(Expedited Programs for RegenerativeMedicine Therapies for Serious Conditions) 和《基于再生医学进步疗法的医疗工具评估》(Evaluationof Devices Used with Regenerative MedicineAdvanced Therapies)[15]。凭据上述指南,再生医学进步疗法包罗细胞治疗、治疗性组织工程产物、人类细胞和组织产物以及使用这些疗法或产物的任何组合产物。FDA 指出,基因治疗包含在这个界说中。截止今朝,FDA 已经授予包罗Abeona公司隐形营养不良型大疱性表松解症的基因校正自体细胞产物E-101、Rocker 制药公司基于慢病毒(LVV)载体治疗范可尼贫血病的基因疗法产物再生医学进步疗法认定。
2018 年,FDA 持续完美基因治疗研发和监管的政策文件系统,更新了3 个指南文件并新发布血友病、视网膜疾病以及罕有病这3 个特定范畴的基因治疗指南,旨在促进基因治疗产物的斥地[16]。与此同时,除了之前的研发和临床试验相关指导原则以外,还针对基因治疗产物的生产环节问题更新了3 个指导原则:《人类基因疗法新药申请(INDs)的化学、制造和掌握(CMC)信息》《在产物生产、患者随访时代,测试基于逆转录病毒基因治疗产物的病毒复制能力》以及《人类基因治疗产物给药的历久随访》。
鉴于再生医学进步疗法范畴储藏的伟大时机与挑战,FDA 行使严厉的法式来完美和澄清司法,标记着所有好处相关偏向前迈出了主要一步。
2018 年5 月,美国国会众议院经由了“测验权法案”,该法案许可在已经测验了所有FDA 许可疗法的患者能够使用尚处于临床试验中的试验药物——只要这些药物经临床试验初步证实平安性,不具备毒性或不威胁生命[17]。该法案不要求保险公司支出临床试验治疗的费用。法案经由今后,美国思想风暴生物科技公司(Brainstorm)公布将经由该法案为一名渐冻症患者供应试验性干细胞疗法。前提是必需知足以下4 个要素前提下,考虑供应:
①出于平安考虑,在临床经验雄厚的处所治疗收益有限的病人;
②确保患者接管试验性疗法的获益和风险教育;
③限制纳入不相符已经开展的临床试验方案的患者,以避免影响试验进展;
④为无法肩负医疗费用的患者追求替代资金。
欧盟

欧盟药品治理局(European MedicinesAgency,EMA ) 对于细胞和基因产物按照人用药品进行治理。将基因治疗产物、细胞治疗产物和组织工程产物界说为进步医疗产物(Advanced therapy medicinal products,ATMPs), 包罗体细胞治疗、基因治疗或组织工程为根蒂的人用药产物。EMA 以专门的划定对此类产物进行集中审评治理,包罗产物生产要求、手艺要求、获准上市的法式、临床试验要求等( 图7)。2004 年公布《Directive2004/23/EC: 人体组织和细胞救助、获得、筛选、处理、留存、贮藏和配送的质量和平安尺度》;2007 年,在对之前相关律例进行整合的根蒂上,公布了《Regulation 1394/2007/EC: 进步治疗医学产物律例》,并成立了进步疗法..(Committee for Advanced Therapies,CAT),负责ATMPs 的监管和咨询,相关工作于2008 年12 月30 日正式实行;2008 年9月通知《人类细胞医学产物指导原则》(Guidelineon Human Cell-based Medical products)庖代了2001 年发布的《体细胞医学产物制造和质量掌握要点》。细胞和基因治疗产物按照药品申报,由EMA 下设的进步疗法..这一多学科..进行审评,审评定见交由人用药品..(CHPA)作出最后建议,最终介绍EMA核准[8](图8)。
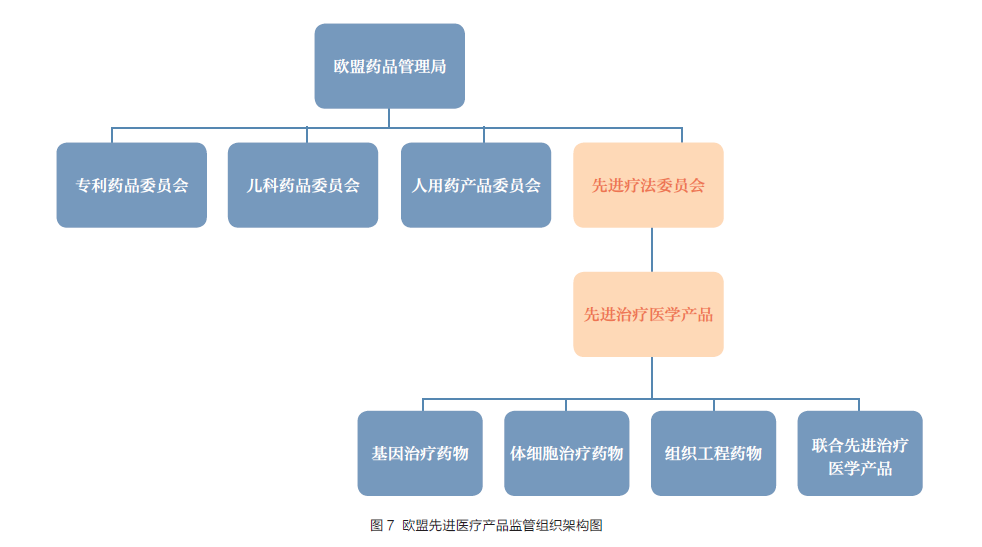

值得存眷的是,《进步治疗医学产物律例》中提出了“病院宽免”条目,许可大夫在经由平安性和有效性验证后,为患者个别进行治疗,首要限制于在医疗机构中进行的个别细胞治疗。宽免权需由欧盟列国家修订至本国的相关医疗律例后得以执行。今朝,英国、德国等已经纳入律例系统,但也有很多国度尚未完成修订律例的工作。
2016 年3 月,EMA 推出了PRIME 方案,皆在加快医药欠缺范畴药品的审评历程[18]。尽管PRIME 与FDA 冲破性疗法认定(breakthroughtherapy designation,BTD) 有所重叠, 但仍所有不同。入围PRIME 的候选药物临床研究水平更低,而立异性更高。如学术机构或中小型药企在临床前研究和药物耐受性试验取得凸起的数据,就更有早期进入PRIME 方案的机会。一旦获得PRIME 认定,EMA 会接纳一系列办法与研发企业持续沟通和跟进。2019 年4 月南京传奇生物科技有限公司与强生制药子公司杨森制药配合斥地的基于BCMA 靶点、用于治疗多发性骨髓瘤的CAR-T 细胞疗法获得了PRIME 认定。
..

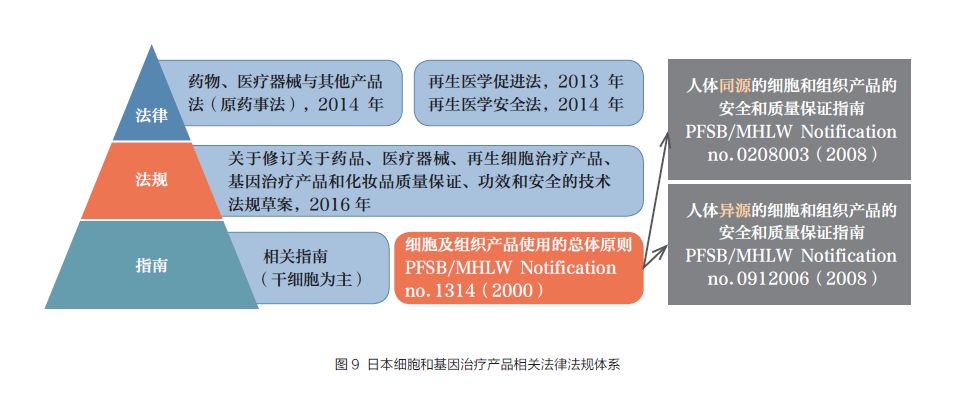
近年来,..当局实施举国计谋,接踵修订出台了有关再生医学新律例,竖立高效的通道促进细胞和生物学等手艺向临床应用转化,以确保..在再生医学范畴的研究和临床治疗优势。..将细胞治疗、基因治疗、组织工程产物从药品、医疗工具的再生医学产物中自力出来零丁监管,并于2013年修订《药事法》,将其改名为《药品和医疗工具与其他产物法》,于2014 年11 月实施,增订了再生医学产物监管的部门。2013 年和2014 年先后发布了《再生医学促进法》和《再生医学平安法》,为相关产物从研发莅临床应用方面供应了司法依据(图9)。2014 年11 月,新的司法框架正式实施以来,更多的企业和研究机构进入再生医疗范畴,再生医疗财富进入活跃期[8]。
..再生医疗范畴的首要国度监管部委包罗厚生劳动省、经济财富省、文部科学省、医药品医疗工具综合机构。四个机关单元单子在研究鞭策、设计斥地、许可认定、品质评价、法式审查等具体事务上各有偏重和分工协作,此外..尺度协会(Japanese Standards Association,JSA) 负责平安性评价等行业尺度制订。
..对细胞和基因治疗产物实行双轨制治理(图10)。整体上,仅是在诊所或病院等机构内部实施的免疫细胞采集和治疗,以及研究者提议的临床试验属于《再生医疗平安确保法》的管辖领域, 由厚生劳动省(Ministry of Health, Laborand Welfare,MHLW)治理并立案。以产物上市为目的的细胞治疗产物或若是有第三方企业等介入免疫细胞的基因把持、加工制备、生产发卖等,则由药品医疗工具治理局(Pharmaceutical andMedical Device Agency,PMDA)治理按照修订后的《药事法》治理[9]。

MHLW 在医疗机构实施的细胞治疗遵照《再生医学平安法》进行监管,监管局限包罗平安性和有效性未经证实的细胞治疗手艺。2010 年以前,细胞治疗只能在具备细胞制备能力的医疗机构开展;2010 年今后,许可向其他不具备能力的医疗机构供应细胞治疗产物,供其给患者使用。今朝已有40 家研究中心具备了细胞治疗天资并获得核准,首要面向研究者进行的临床研究和雷同欧盟“病院宽免”形式的细胞治疗应用。
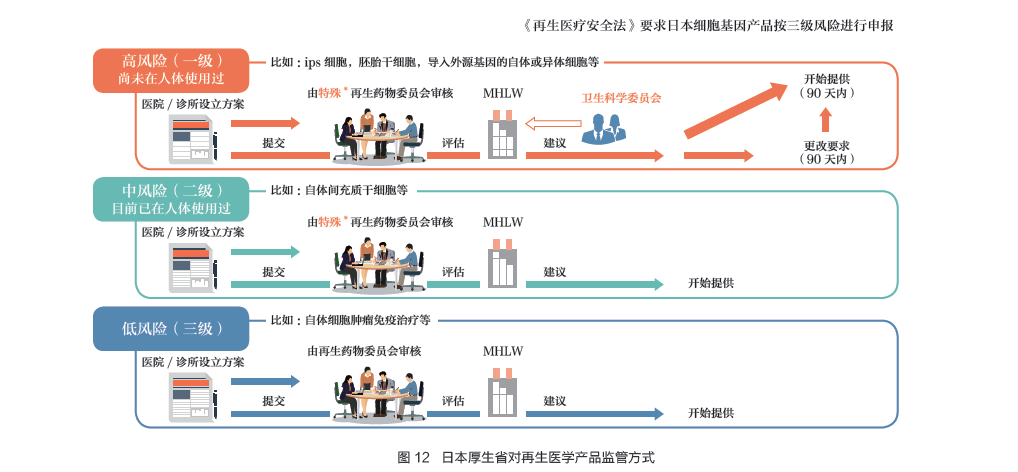
依据《再生医学平安法》,..细胞和基因治疗产物按照三级风险进行申报:未在人体使用过,如iPS 细胞、胚胎干细胞和导入外源基因的自体或异体细胞等属于第一级高风险产物;已经在人体使用过,如自体间充质干细胞等属于二级中风险产物;自体细胞肿瘤免疫治疗等则属于三级低风险产物(图11)。

医疗机构凭据风险分级,设立研究规划和实施方案,向MHLW 提交申请,MHLW 凭据分歧细胞疗法对患者带来的潜在风险分歧,离别设有分歧的审批法式。凭据风险品级组织再生药物..审核,评估究竟听取卫生科学..的定见[9](图12)。
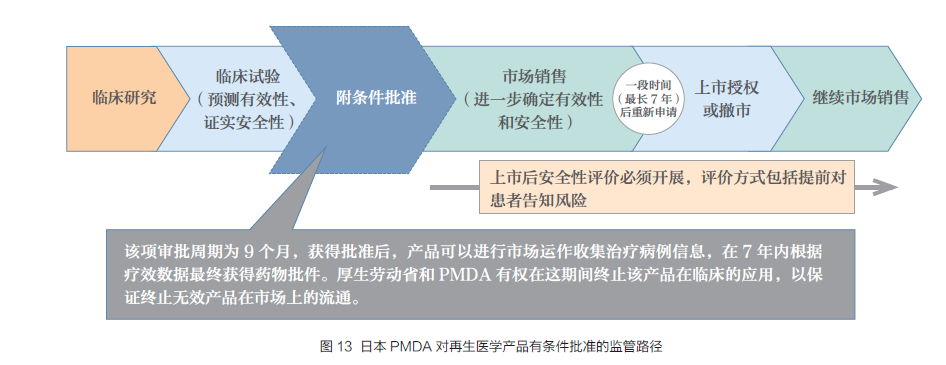
..再生医学产物由PMDA 依据《药品、医疗工具与其他产物法》进行监管,其评估中心下设细胞与组织产物审批办公室负责具体审批事务。再生医学产物必需知足以下前提:
适应证为危及生命的疾病,治疗方式为知足需求的立异性产物,并经由初步的平安性和有效性验证,相符相关监管律例政策要求。再生医学产物在原有药品9 个月审评法式的根蒂上,在临床研究证实其平安性和有效性之后,增加了前提限制性准入许可。再生医学产物开展临床和上市审批周期都大大加速。前提限制性准入许可时间最长为7 年,在临床试验和应用中证实细胞治疗产物有效性后,产物可申请作为再生医学产物正式核准上市。7 年时间到期后,可再次申请或退出市场(图13)。在此时代,PMDA 和MHLW 有权完结该产物在临床的应用,以包管无效产物不再在市场畅通。今朝已有一种骨骼肌细胞产物用于缺血性心脏病导致的严重心衰获得有前提限制性准入许可进入市场,考查期为5 年。
..也出台了一系列研究指南和规范,包罗《干细胞临床研究指南》《人体自体细胞组织产物质量掌握与平安指南》《细胞组织把持原则》等。今朝..当局也在考虑对细胞治疗的监管立法,竖立分级治理轨制,针对诱导性多能干细胞、间充质干细胞、免疫细胞疗法制订分歧级其余治理法子。

关于细胞和基因治疗成品的监管,无论是科学研究和财富成长处于世界领先的美国和欧盟,照样已有上市细胞和基因治疗产物的亚洲国度..和韩国,均从司法、律例和手艺指南等角度络续健全和完美,初步竖立了对照完整的监管框架。无论是美国为代表的单轨制照样..为代表的双轨制监管模式,都是在充裕熟悉细胞和基因治疗产物特点和风险的根蒂上,全盘考虑本国根基国情、经济、文化、科学手艺成长和财富计谋结构等要素,确定了顶层框架,并经由司法、律例到行业指南分歧层级政策系统,实施分级分类治理,络续提拔相关范畴手艺,有效促进财富升级(表2)。

我国细胞和基因治疗根蒂研究和临床试验开展的相对较早,履历了多个阶段、多种模式的索求。1993 年原国度卫生部发布了《人的体细胞治疗及基因治疗临床研究质控要点》《关于禁止LAK 细胞制剂不法临床应用的通知》。1998 年原国度药品监视治理局成立后,在2002 年发布《药品..治理法子(试行)》中将细胞治疗和基因治疗产物作为治疗性生物成品3 类进行治理。2009 年原国度卫生部发文,将细胞治疗作为第三类医疗手艺进行治理,许可临床应用和收费。2015 年“魏则西”事件后,原国度卫计委禁止造血干细胞和免疫细胞等第三类医疗手艺的临床应用,同时对干细胞临床研究进行立案治理[19]。
在近10 年的细胞治疗手艺属性和产物属性的争议中,2015 年之前共30 项细胞成品按照药品申报..,个中5 个产物获得临床试验批件。2017 岁尾,原国度食品药品监视治理总局公布了《细胞治疗产物研究与评价手艺指导原则(试行)》后,仅一年多时间,49 项细胞成品申请药品..临床试验,个中10 余项进步水平的CAR-T、TCR-T 产物获批临床试验,标记着我国细胞和基因治疗有了正规化成长的道路。2019 岁首,国度卫健委发布的《生物医学新手艺临床应用治理条例(收罗定见稿)》和《体细胞治疗临床研究和转化应用治理法子(收罗定见稿)》再次引起了国表里相关方的商议和争议。
凭据课题组前期调研发现,我国细胞和基因治疗财富体量伟大,除..自治区以外的所有省、自治区、直辖市有上千家企业、医疗机构、高校及科研院所开展该范畴的根蒂研究和临床研究,涉及干细胞、免疫细胞和少量其他成体细胞等几十种细胞类型,适应证笼盖了近百种难治性疾病,包罗恶性肿瘤、传染性疾病、自身免疫性疾病、心血管疾病等重大疾病,有伟大的成长空间和市场。行业成长迅猛。仅2017 年后,49 项细胞治疗产物被国度药品监视治理部门受理,一批具有高起点、较高研发能力的立异型企业快速涌现,国外进步企业、行业巨头经由多种资源形式将进步的研发理念带进国内,很大水平上提高了国内该范畴的研发水平。但调研发现,反复研究多,研发品种构造较为单一,开展临床研究的机构水平参差不齐,经由监管部门立案审核的临床研究比例低,科学性和规范度不敷,是以风险较大。
“十三五”国度计谋性新兴财富成长规划将斥地基因治疗、细胞治疗,强化科学高效监管和政策支撑等作为鞭策生物医药行业跨越升级的重点计谋义务[20]。近5 年国度在干细胞以及相关范畴的科研经费投入总额跨越了10 亿,对相关根蒂研究、要害手艺和资源..赐与鼎力的支撑。但在细胞和基因治疗范畴的应用转化和财富化还存在很大的瓶颈,至今没有产物上市。需要科研机构、医药财富、医疗机构与相关当局监管部门的合力,研究制订政策顶层框架与分歧阶段的成长路径,以鞭策我国细胞与基因治疗范畴健康有序和高质量成长。
为此,建议在周全认识我国细胞和基因治疗行业成长近况和国际成长趋势,充裕认识细胞和基因治疗产物与传统小分子化药、大分子生物成品的区别和特征的根蒂上,需要凭据这类新兴治疗产物的特点,遵循其研究、斥地、生产和使用等要害环节的科学纪律,连系实际临床使用情形,周全梳理瓶颈问题,推进该范畴监管科学研究,索求新的方式、新尺度、新路径,研究制订与之相适应的科学监管的路径和律例系统,以鼓励和指导科学和规范的研发,解决公家和患者对新兴治疗产物的临床治疗需求。基于对我国国情和行业近况的剖析,在充裕借鉴国外监管系统的根蒂上,针对我国今朝细胞治疗监管政策,课题组提出如下建议:
1.从顶层设计上明确细胞和基因治疗产物的监管系统,厘清药监局和卫健委的监管界限和本能。竖立以患者为中心,即珍爱患者平安和权益为焦点的,以全生命周期质量系统为根蒂的,科学的监管律例系统。
2.建议监管轨制系统的设立需要充裕考虑该范畴产物的特征和科学纪律,基于风险掌握的根基原则,施展整体性的同时,兼顾天真性的需要。例如竖立和完美细胞和基因治疗产物对于终末期患者的试验性治疗的特别机制。
3.监管系统设计,建议在整体框架考虑下,在厘清治理界限的情形下,凭据相关本能,竖立互相协同的监管系统。
4. 建议对于分歧类其余产物,凭据风险品级分级监管,提高监管效率,有效掌握风险。
5.设立专门的细胞和基因治疗产物专业..,为该范畴监管部门供应手艺撑持,为络续完美相关政策和指南原则供应咨询。
6.鼓励竖立区域性细胞和基因治疗产物第三方检测机构,络续完美该范畴监管手艺指南系统。
7.鞭策该范畴监管科学研究。除了正视评价细胞和基因治疗产物平安性和有效性的新尺度、新方式和新路径以外,也应前瞻性地结构临床支出、报销等方面的配套政策研究。
综上所述,我国今朝细胞和基因治疗行业成长迅猛,监管系统亟待完美,若何竖立科学、合理、完美的监管政策系统,考量着科学家和监管者的聪明、胆识和气势。
本文数据由《细胞和基因治疗监管政策研究》课题组供应,课题经费获国度药品监视治理局支撑
第一作者简介
配合通信作者简介



大家好,小乐今天来为大家解答qq好友管理在哪里以下问题,qq好友管理app很多人还不知道,现在让我们一起来看看吧!1、在打开的QQ主界面,右键点
大家好,小乐今天来为大家解答工作日程安排软件以下问题,工作日程表软件很多人还不知道,现在让我们一起来看看吧!1、优秀的时间管理工具
大家好,小丽今天来为大家解答毒网电影中文以下问题,毒网电影中文很多人还不知道,现在让我们一起来看看吧!1、边境小城吉川市,发生贩卖毒
大家好,小美今天来为大家解答应收账款分录以下问题,收回前期已核销的应收账款分录很多人还不知道,现在让我们一起来看看吧!1、销售商品时
大家好,小美今天来为大家解答吉田优希以下问题,吉田友一很多人还不知道,现在让我们一起来看看吧!1、姓名:吉田有希艺名:YUUKI生日:1989年
迎接人人积极投稿,末学急需材料,投稿邮箱:nzjsb2020@163.com三年了,一千多个日夜,终于,我再次可以感触到早晨平坦的阳光下,轻风拂过面颊的惬
大家好,小乐今天来为大家解答是否享受一补怎么填以下问题,是否享受生活补助怎么填很多人还不知道,现在让我们一起来看看吧!1、法律分析:
传统小分子药物的药理感化是一药对应一靶标,即使一药多靶 (包罗脱靶)也是1:1的离别连系。药物与靶标的连系遵循质量感化定律,连系的热力学和
本文内容来自网友供稿,如有信息侵犯了您的权益,请联系反馈核实
Copyright 2024.爱妻自媒体,让大家了解更多图文资讯!